細胞外ヒストンは生体防御のダークヒーローなのか?
「生物学の新知識」に抗菌作用を持つ正義の味方として過去4回*1~4にわたり紹介されていた細胞外ヒストン。8年半の沈黙を破り再登場したその姿には、敗血症に伴う全身性の炎症を陰で操る暗黒面がくっきりと浮かび上がっていたのであった...。生体防御におけるヒストンは、果たしてヒーローなのか、それとも...。
The Bright Side of Histone H3
NETs恢々疎にして漏らさず
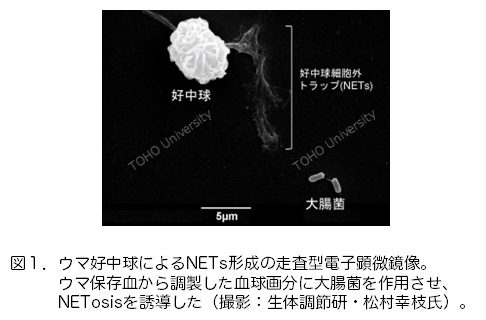
ヒストン群タンパク質は真核細胞のヌクレオソームを構成し遺伝子の転写制御に深く関わる核内タンパク質としてよく知られていますが、実際には細胞質や細胞表面にも存在し、血液や体液中にも恒常的に検出されています。これらは細胞外ヒストンと呼ばれていて、核内に在るときとは大きく異なる作用を示します。ヒストンには5種類のサブタイプ(H1, H2A, H2B, H3, H4)が存在しますが、いずれも抗菌活性を有しており、外分泌物として直接、あるいは好中球が体内で細菌感染した際に生じる好中球細胞外トラップ(Neutrophil Extracellular Traps: NETs)(図1)の構成成分として、病原性微生物の排除に寄与しています。ちなみにNETsとは、細菌に感染した好中球がNETosisという独特の細胞死を引き起こすことで細胞外へ放出する網(ネット)状の構造物のことで(よくもまあ思いついた素晴らしいネーミングセンス!)、好中球に由来するDNAやヒストン、好中球エラスターゼ、抗菌ペプチドなどを含み、これらを介して細菌を捕捉し殺菌すると考えられています(文献1)。このネタ、「はたらく細胞」(清水茜著、講談社)の好中球さんに使って欲しいなあと思いつつ、でも擬人化してこれをやったら相当怖い...。
沈黙は菌
さてこの沈黙の8年半、私たちの研究室では「*4抗菌性ヒストンを追いつめろ!Part II:Arg-rich型ヒストンの逆襲」で紹介したヒストンH3の抗菌活性の詳細を追いかけていました。当初私たちが報告していたヒストンH3の抗菌活性は大腸菌と黄色ブドウ球菌に対するもののみだったので(文献2, 3)、さらにその普遍性を検証するため、複数種類の細菌や病原性真菌であるカンジダ菌に対する作用とそのメカニズムの解析に取り組みました。図2で示しましたように、ヒストンH3で処理した各種病原体の細胞は細胞膜破壊を引き起こし、形態異常を呈していることがわかりました。ちなみにカビなどの仲間である真菌に対してヒストンH3が殺菌効果を示すことがこの研究によって初めて明らかにされました(文献4)。

毒素に交われば薬となる
ヒストンH3の抗菌作用機序の解析の過程において、ヒストンH3が細菌の表層に存在する内毒素(エンドトキシン)と強く結合することも発見しました(図3)。エンドトキシンとの結合の解析には、当研究室と埼玉大学のチームで開発したEnzyme-linked Endotoxin Binding Assay(ELEBA)法という高感度のエンドトキシン検出法を用いました(文献5)。ヒストンH3が細菌の細胞膜を破壊する際にはまず表面にあるエンドトキシンに引きつけられて細胞とコンタクトすることが予測できます。また、破壊された細菌から分離したエンドトキシンを、ヒストンがトラップしている可能性も考えられます。

The Dark Side of Histone H3
三日会わざれば刮目して見よ
私たちがヒストンの抗菌活性に着目し始めた頃、ヒストンの細胞毒性に関する衝撃的な報告がなされました(文献6)。その内容を簡単にまとめると、「マウスに敗血症を誘発させると血液中のヒストン濃度が上昇し、ヒストンを血中に過剰投与すると敗血症で見られる全身性の炎症や多臓器不全のような症状を引き起こす」となります。この報告を契機にヒストンのダークサイドが広く世の中に知られることとなり、細胞外ヒストンの生体に対するdisadvantageousな機能の研究が活発化することとなりました。NETsの登場によりヒストンを英雄視するようになっていた抗菌性ヒストンの研究者たち(=主に私たちですが)にとって、まさに冷水を浴びせられるようなヒストンの豹変ぶりでした。ヒストンよ、お前もか...。
毒を盛らわば細胞まで
といいつつ、私たちも培養細胞レベルにおいて、実はしっかりとヒストンH3における細胞毒性の存在を検出していました。というのも、細胞毒性や溶血活性は抗菌性を持つペプチドやタンパク質をもしも薬として使うのであれば、宿主の細胞に与える害ができるだけ少ない・小さい必要があるので、これらの活性は必ずチェックしておかねばなりません。そこで私たちはヒストンH3が哺乳類の様々な細胞に及ぼす影響を走査型電子顕微鏡を用いて検証したのですが、それはそれは細胞が可哀想になるくらいの派手な細胞破壊ぶりでした(図4)。この図から、血流で運ばれながら血管内皮細胞を壊しまくっているヒストンH3の姿が容易に想像できると思います。また、病原体細胞に対する効果と比較すると、ヒストンH3は真核細胞に対する細胞毒性のほうが高いと判断しています。今のところ、ブライトサイドよりもダークサイドの方が強いといった感じで、なんだか映画「スター・ウォーズ」のアナキン・スカイウォーカーやダース・ベイダーを彷彿させます。

呉越同舟、同じ穴のムジナ
ところで、ヒストンを投与するとどうして敗血症のような症状になるのでしょうか?敗血症というのは感染症に伴う全身性の炎症反応であり、炎症性サイトカインが過剰に生産されている状態にあることなのですが、その引き金となるのが免疫系細胞や血管内皮細胞のToll様受容体(TLRs)へのエンドトキシンの結合です。TLRsはエンドトキシンを結合することにより核内因子κB(NF-κB)を活性化し、活性化したNF-κBは炎症性サイトカインの遺伝子発現や放出をもたらし、炎症反応を惹起します。この炎症反応が過剰になるのが全身性炎症性反応症候群(SIRS)です。そしてなんとヒストンは、エンドトキシンと同じTLRsに結合し非感染性の炎症反応を惹起する、ダメージ関連分子パターン(DAMPS)の一種だったのでした(文献7)。本来は敵対関係にある(?)はずの細菌/エンドトキシンとヒストンとは、実はTLRsという同じ船に乗り、同じ航路を辿ってSIRSを引き起こしていた、ということです(図5)。

Histone H3 is a Double-Edged Sword
一連の研究から、ヒストンH3には抗菌活性と細胞毒性とが共存することが示されました。生体防御において相反するこの2つの作用はヒストンH3分子中の同じ領域に由来するのか、それともそれぞれの作用は異なる領域に由来するのか、どうなのでしょうか?この素朴な疑問を解決するため、私たちはでヒストンH3分子の全長をほぼ均等に4分割した配列を持つペプチドを合成し、これらを使って抗菌活性と細胞毒性を検証してみました。その結果、抗菌活性領域と細胞毒性領域は明確に異なっており、2つの活性は同じ領域ではほとんど共存しないことが明らかとなりました(図6)。つまり、ヒストンH3分子は文字通り諸刃を持つ剣であり、それぞれ切る(切れる)対象が異なっていることがわかりました。

終わりに
今回の「細胞外ヒストンは生体防御のダークヒーローなのか?」、いかがだったでしょうか?細胞外ヒストンの研究はまだまだ発展途上で、やりたいこと・やらねばならぬことがたくさんあります。次回、また執筆の機会が廻って参りましたら、さらなる進捗をお伝えできればと思っております。
岩室 祥一(東邦大学理学部生物学科 生体調節学研究室)
参考サイト
- *1 抗菌性ヒストンを追いかけろ! Part I
https://www.toho-u.ac.jp/sci/bio/column/017048.html - *2 抗菌性ヒストンを追いかけろ!Part II
https://www.toho-u.ac.jp/sci/bio/column/018701.html - *3 抗菌性ヒストンを追いつめろ! Part I
https://www.toho-u.ac.jp/sci/bio/column/024172.html - *4 抗菌性ヒストンを追いつめろ!Part II:Arg-rich型ヒストンの逆襲
https://www.toho-u.ac.jp/sci/bio/column/033075.html
参考文献
- Brinkman et al. Science 303, 1532–1535, 2004.
- Tagai et al. Peptides 32, 1003–1009, 2011.
- Morita et al. Peptides 48, 75–82, 2013.
- Tanaka et al. Antibiotics 11, 1240, 2022.
- Ogawa et al. Antibiotics 9, 457, 2020.
- Xu et al. Nat Med 15, 1318–1321, 2009.
- Abrams et al. Am J Respir Crit Care Med 187, 160–169, 2013.




























