プレスリリース 発行No.641 平成27年11月13日
体内時計を駆動する日周性酵素反応を発見
~ 体内時計の機能不全による様々な疾患の予防や治療への貢献に期待 ~
東邦大学医学部 田丸輝也講師(細胞生理学分野)と、東京大学大学院理学研究科 小澤岳昌教授(化学専攻)の研究チームは、マウスの皮膚、脳、肝臓などの細胞・組織を用いた研究で、哺乳類の体内時計を駆動する日周性酵素活性の振動メカニズムを解明したと発表しました。
研究は、体内時計の中核分子である時計タンパク質の一種CRYが、タンパク質リン酸化という酵素反応の周期的抑制によって日周性リン酸化振動を生むことを発見し、生細胞におけるタンパク質機能の日周性リズムをリアルタイムで捉えることに成功したものです。
今後この成果をもとに、日周性リン酸化振動システムをターゲットにした体内時計の調整法を開発することで、現代人のライフスタイルの変化や多様化(夜型生活、シフトワーク、グローバル化など)による体内時計の機能不全を要因とする睡眠障害や、糖尿病、循環器系疾患などの生活習慣病や癌をはじめとした様々な健康問題、疾患の予防、改善、及び治療に役立てることが期待されます。
この研究成果は、11月12日付けの、米国プロスバイオロジー誌に掲載されました。
研究発表内容の詳細は別紙のとおりです。
研究は、体内時計の中核分子である時計タンパク質の一種CRYが、タンパク質リン酸化という酵素反応の周期的抑制によって日周性リン酸化振動を生むことを発見し、生細胞におけるタンパク質機能の日周性リズムをリアルタイムで捉えることに成功したものです。
今後この成果をもとに、日周性リン酸化振動システムをターゲットにした体内時計の調整法を開発することで、現代人のライフスタイルの変化や多様化(夜型生活、シフトワーク、グローバル化など)による体内時計の機能不全を要因とする睡眠障害や、糖尿病、循環器系疾患などの生活習慣病や癌をはじめとした様々な健康問題、疾患の予防、改善、及び治療に役立てることが期待されます。
この研究成果は、11月12日付けの、米国プロスバイオロジー誌に掲載されました。
研究発表内容の詳細は別紙のとおりです。
以上
【別紙(抜粋)】体内時計を駆動する日周性酵素反応を発見
発表者:
田丸輝也(東邦大学医学部生理学講座細胞生理学分野 講師)
小澤岳昌(東京大学大学院理学研究科化学専攻 教授)
小澤岳昌(東京大学大学院理学研究科化学専攻 教授)
発表のポイント:
◆どのような成果を出したのか 哺乳類の体内時計を駆動する酵素CK2による時計タンパク質BMAL1の日周リン酸化活性の振動メカニズムを解明した。
◆新規性(何が新しいのか)
哺乳類体内時計の中核を担う日周性酵素活性の振動メカニズムを解明した。 時計タンパク質CRYがタンパク質リン酸化抑制によって日周リン酸化振動を生むことを発見した。
生細胞におけるタンパク質機能の日周リズムをリアルタイムで捉えることに成功した。
◆社会的意義/将来の展望
体内時計の機能不全は、様々な疾患(生活習慣病、癌等)の要因になる為、日周性酵素反応を標的とする新たなアプローチから医療に貢献することが期待できる。
◆新規性(何が新しいのか)
哺乳類体内時計の中核を担う日周性酵素活性の振動メカニズムを解明した。 時計タンパク質CRYがタンパク質リン酸化抑制によって日周リン酸化振動を生むことを発見した。
生細胞におけるタンパク質機能の日周リズムをリアルタイムで捉えることに成功した。
◆社会的意義/将来の展望
体内時計の機能不全は、様々な疾患(生活習慣病、癌等)の要因になる為、日周性酵素反応を標的とする新たなアプローチから医療に貢献することが期待できる。
発表概要:
全身の細胞で時を刻む体内時計は、さまざま生理機能が最適な時刻に働くベースとなる。現代社会のライフスタイルによる体内時計の乱れは、生活習慣病、癌等のさまざまな疾患の増加の一因となっている。体内時計は、いくつかの時計タンパク質で構成される中核ループと、複数の調節ループが互いに歯車(ギア)として巧みに噛み合って、1日周期で作動している。今回、東邦大学医学部の田丸輝也講師、東京大学大学院理学系研究科の小澤岳昌教授らは、体内分子時計の複数の歯車を連動させるクリティカルな歯車(調節ループ)として、CK2という酵素による時計タンパク質BMAL1の日周性リン酸化反応のプロセスを、光を利用したリアルタイム測定などで捉え、日周性酵素反応の振動メカニズムを解明した(図1)。この振動には、時計タンパク質CRY(クリプトクローム)による酵素活性の抑制が重要な役割を果たしていた。
本成果は日周性酵素反応を標的とする新たなアプローチから医療に貢献することが期待できる。
本成果は日周性酵素反応を標的とする新たなアプローチから医療に貢献することが期待できる。
発表内容:
全身の細胞で時を刻む体内時計は、ゲノム遺伝子の約10%に相当する様々な生理機能に日内リズムもたらし、それぞれが調和した最適なタイミングで働くベースとなる。現代社会における夜型化、グローバル化は、人類史上かつてないほど体内時計を攪乱している。これは、長い進化の末に獲得した体内時計をベースとした適応防御プログラムに作動不全をもたらし、生活習慣病、癌などの様々な疾患のリスクを高めていると考えられる。したがって、体内時計の作動メカニズムにおけるクリティカルな調節シグナルを理解することは、現代医学における重要な課題である。体内時計は細胞単位の分子時計で、時計遺伝子の転写-翻訳による負のフィードバックループが時計の中核となる歯車の役割を担っている。この中核(フィードバック)ループにおいて、哺乳類では時計タンパク質BMAL1-CLOCK複合体が時計遺伝子Cry(クリプトクローム)1/2, Per1/2の転写を促進し、その転写産物であるCRY1/2, PER1/2がBMAL1-CLOCKによる転写を抑制する一連のプロセスが1日周期で起こる。さらに時計タンパク質の修飾系などで構成される複数の調節ループも加わり、互いに歯車(ギア)として巧みに噛み合って分子時計が作動している。
本研究では、体内分子時計の複数の歯車を連動させるクリティカルな歯車(調節ループ)として、CK2という酵素による時計タンパク質BMAL1の日周性リン酸化反応のプロセスを捉え、日周性酵素反応の振動メカニズムを解明した。この振動には、時計タンパク質CRYの新しい機能である酵素活性(BMAL1リン酸化)の抑制が重要な役割を果たしていた。
本研究のきっかけは、1)Cry1/2遺伝子を欠損した時計機能不全細胞において、BMAL1のリン酸化が常に高いレベルでみられる [1] 2)正常細胞において、CK2α(触媒サブユニット)によるBMAL1(のSer90)の日周性リン酸化がBMAL1-CLOCK複合体の核移行と日周性時計遺伝子発現をトリガーする[2]という現象である(図2)。今回、まず、BMAL1-Ser90リン酸化の新規阻害剤を使って、脳の中枢体内時計である視交叉上核や、末梢体内時計の肝臓においても、BMAL1-Ser90リン酸化がクリティカルな制御プロセスであることを示した。
上記の背景は、CRY欠損細胞において、BMAL1-Ser90のリン酸化が常に高いレベルにある可能性を示唆した。本研究では、まず、この可能性を検証した。その結果、1)CRY欠損細胞では、常に高いレベルのBMAL1-Ser90リン酸化がおきていることが実証され、日周性リン酸化振動も損なわれていた(図2)。2)正常細胞では、BMAL1とCK2β調節サブユニットの結合に日周リズムがみられ、BMAL1–CK2β結合が高い時刻において、BMAL1-Ser90リン酸化は低い逆位相を示し、同時にBMAL1–CRY結合は高い同位相のリズムを示した(図2)。3)試験管内反応で、CK2βによりBMAL1-Ser90リン酸化が阻害された。これらの結果から、「CRYが促進するBMAL1–CK2β結合による日周性阻害が、BMAL1-Ser90リン酸化リズムを駆動する」ことが示唆された。この予想は、4)CRY欠損細胞ではBMAL1–CK2β結合が低下し、その日周性も損なわれていたが(図2)、この細胞にCRYを発現させると日周性BMAL1-Ser90リン酸化とBMAL1–CK2β結合がともに回復することで裏付けられた。
さらに、ホタルの発光を利用したBMAL1–CK2β結合のリアルタイム測定[3]によって、生きた細胞において、1)CRYがBMAL1–CK2β結合を促進する 2)日周性BMAL1–CK2β結合リズムが日周性BMAL1リン酸化リズムと逆位相になる 3)CRYのFAD結合領域と、BMAL1のC末端領域の特にCLOCKによるBMAL1のアセチル化修飾部位(Lys537)がCRY促進性BMAL1–CK2β結合に必要であることを明らかにした(図1,2)。BMAL1アセチル化制御の重要性の裏付けとして、BMAL1の脱アセチル化酵素SIRT1を欠損しアセチル化が亢進した細胞では、BMAL1–CK2β結合が亢進し、BMAL1-Ser90リン酸化が低下することも示した。逆に、BMAL1のアセチル化には、BMAL1-Ser90リン酸化が先行して起こることが必要なことが判った(図2)。
図1は、新たに解明した分子時計の振動メカニズムを示す。CK2αがBMAL1-Ser90をリン酸化すると日周性遺伝子発現のスイッチが入る。それによって増えたCRYが、アセチル化をきっかけにBMAL1に結合し、日周性遺伝子の転写が抑制される。さらに、CRYはBMAL1–CK2βの結合を促進して、BMAL1リン酸化活性を抑制する。最後にBMAL1は脱リン酸化、脱アセチル化され、分解を受けなかったものは次のサイクルで、新規合成されたBMAL1とともに再びリン酸化を受ける。このサイクルが1日周期で起こる。 本成果は、ヒトの体内時計が関わる生理現象を深く理解し、日周性酵素反応を標的とする新たなアプローチから、生活習慣病、癌、睡眠障害などの医療に貢献することが期待できる。
(参考文献)
1.Tamaru T, Isojima Y, van der Horst GT, Takei K, Nagai K, Takamatsu K. Nucleocytoplasmic shuttling and phosphorylation of BMAL1 are regulated by circadian clock in cultured fibroblasts. Genes Cells. 2003;8:973-83.
2.Tamaru T, Hirayama J, Isojima Y, Nagai K, Norioka S, Takamatsu K, Sassone-Corsi P. CK2alpha phosphorylates BMAL1 to regulate the mammalian clock. Nat Struct Mol Biol. 2009;16: 446-48.
3.Hida N, Awais M, Takeuchi M, Ueno N, Tashiro M, Takagi C, Singh T, Hayashi M, Ohmiya Y, Ozawa T. High-sensitivity real-time imaging of dual protein-protein interactions in living subjects using multicolor luciferases. PLoS One. 2009;4(6):e5868.
本研究は,日本学術振興会 基盤研究(S)(研究課題番号:26220805)の一環として行われました。
本研究では、体内分子時計の複数の歯車を連動させるクリティカルな歯車(調節ループ)として、CK2という酵素による時計タンパク質BMAL1の日周性リン酸化反応のプロセスを捉え、日周性酵素反応の振動メカニズムを解明した。この振動には、時計タンパク質CRYの新しい機能である酵素活性(BMAL1リン酸化)の抑制が重要な役割を果たしていた。
本研究のきっかけは、1)Cry1/2遺伝子を欠損した時計機能不全細胞において、BMAL1のリン酸化が常に高いレベルでみられる [1] 2)正常細胞において、CK2α(触媒サブユニット)によるBMAL1(のSer90)の日周性リン酸化がBMAL1-CLOCK複合体の核移行と日周性時計遺伝子発現をトリガーする[2]という現象である(図2)。今回、まず、BMAL1-Ser90リン酸化の新規阻害剤を使って、脳の中枢体内時計である視交叉上核や、末梢体内時計の肝臓においても、BMAL1-Ser90リン酸化がクリティカルな制御プロセスであることを示した。
上記の背景は、CRY欠損細胞において、BMAL1-Ser90のリン酸化が常に高いレベルにある可能性を示唆した。本研究では、まず、この可能性を検証した。その結果、1)CRY欠損細胞では、常に高いレベルのBMAL1-Ser90リン酸化がおきていることが実証され、日周性リン酸化振動も損なわれていた(図2)。2)正常細胞では、BMAL1とCK2β調節サブユニットの結合に日周リズムがみられ、BMAL1–CK2β結合が高い時刻において、BMAL1-Ser90リン酸化は低い逆位相を示し、同時にBMAL1–CRY結合は高い同位相のリズムを示した(図2)。3)試験管内反応で、CK2βによりBMAL1-Ser90リン酸化が阻害された。これらの結果から、「CRYが促進するBMAL1–CK2β結合による日周性阻害が、BMAL1-Ser90リン酸化リズムを駆動する」ことが示唆された。この予想は、4)CRY欠損細胞ではBMAL1–CK2β結合が低下し、その日周性も損なわれていたが(図2)、この細胞にCRYを発現させると日周性BMAL1-Ser90リン酸化とBMAL1–CK2β結合がともに回復することで裏付けられた。
さらに、ホタルの発光を利用したBMAL1–CK2β結合のリアルタイム測定[3]によって、生きた細胞において、1)CRYがBMAL1–CK2β結合を促進する 2)日周性BMAL1–CK2β結合リズムが日周性BMAL1リン酸化リズムと逆位相になる 3)CRYのFAD結合領域と、BMAL1のC末端領域の特にCLOCKによるBMAL1のアセチル化修飾部位(Lys537)がCRY促進性BMAL1–CK2β結合に必要であることを明らかにした(図1,2)。BMAL1アセチル化制御の重要性の裏付けとして、BMAL1の脱アセチル化酵素SIRT1を欠損しアセチル化が亢進した細胞では、BMAL1–CK2β結合が亢進し、BMAL1-Ser90リン酸化が低下することも示した。逆に、BMAL1のアセチル化には、BMAL1-Ser90リン酸化が先行して起こることが必要なことが判った(図2)。
図1は、新たに解明した分子時計の振動メカニズムを示す。CK2αがBMAL1-Ser90をリン酸化すると日周性遺伝子発現のスイッチが入る。それによって増えたCRYが、アセチル化をきっかけにBMAL1に結合し、日周性遺伝子の転写が抑制される。さらに、CRYはBMAL1–CK2βの結合を促進して、BMAL1リン酸化活性を抑制する。最後にBMAL1は脱リン酸化、脱アセチル化され、分解を受けなかったものは次のサイクルで、新規合成されたBMAL1とともに再びリン酸化を受ける。このサイクルが1日周期で起こる。 本成果は、ヒトの体内時計が関わる生理現象を深く理解し、日周性酵素反応を標的とする新たなアプローチから、生活習慣病、癌、睡眠障害などの医療に貢献することが期待できる。
(参考文献)
1.Tamaru T, Isojima Y, van der Horst GT, Takei K, Nagai K, Takamatsu K. Nucleocytoplasmic shuttling and phosphorylation of BMAL1 are regulated by circadian clock in cultured fibroblasts. Genes Cells. 2003;8:973-83.
2.Tamaru T, Hirayama J, Isojima Y, Nagai K, Norioka S, Takamatsu K, Sassone-Corsi P. CK2alpha phosphorylates BMAL1 to regulate the mammalian clock. Nat Struct Mol Biol. 2009;16: 446-48.
3.Hida N, Awais M, Takeuchi M, Ueno N, Tashiro M, Takagi C, Singh T, Hayashi M, Ohmiya Y, Ozawa T. High-sensitivity real-time imaging of dual protein-protein interactions in living subjects using multicolor luciferases. PLoS One. 2009;4(6):e5868.
本研究は,日本学術振興会 基盤研究(S)(研究課題番号:26220805)の一環として行われました。
発表雑誌:
雑誌名:「PLoS Biology (プロスバイオロジー)」(オンライン版:11月12日, 13(11):e1002293)
論文タイトル:
CRY Drives Cyclic CK2-mediated BMAL1 Phosphorylation to Control the Mammalian Circadian Clock
著者:
Teruya Tamaru*, Mitsuru Hattori, Kousuke Honda, Yasukazu Nakahata, Paolo Sassone-Corsi, Gijsbertus T. J. van der Horst*, Takeaki Ozawa* and Ken Takamatsu
DOI:10.1371/journal.pbio.1002293
雑誌URL:http://journals.plos.org/plosbiology/article?id=10.1371/journal.pbio.1002293
論文タイトル:
CRY Drives Cyclic CK2-mediated BMAL1 Phosphorylation to Control the Mammalian Circadian Clock
著者:
Teruya Tamaru*, Mitsuru Hattori, Kousuke Honda, Yasukazu Nakahata, Paolo Sassone-Corsi, Gijsbertus T. J. van der Horst*, Takeaki Ozawa* and Ken Takamatsu
DOI:10.1371/journal.pbio.1002293
雑誌URL:http://journals.plos.org/plosbiology/article?id=10.1371/journal.pbio.1002293
用語解説:
酵素;触媒反応を担う分子
CK2;タンパク質リン酸化と反応を触媒する酵素の一つで、CK2αという触媒反応を担う部分(サブユニット)とCK2βという反応の調節を担う部分からなる。別名カゼインキナーゼ2。
タンパク質リン酸化;タンパク質の特定のアミノ酸(BMAL1ではSer90, 90番目のセリン)にリン酸を化学結合させる修飾反応で、様々なタンパク質の機能調節に関わる。
時計遺伝子;体内時計機能の中核を担う遺伝子で、時計タンパク質をコードする。この遺伝子を壊すと、体内時計機能が消失する。
時計タンパク質;体内時計機能の中核を担うタンパク質で、日周性遺伝子発現の調節に関わる。
時計タンパク質BMAL1; 日周性遺伝子発現を促進する。
BMAL1–CLOCK複合体;時計タンパク質BMAL1とCLOCKが1対1で結合したもので、BMAL1はこの形で、日周性遺伝子発現を促進できるようになる。
時計タンパク質CRY; 時計遺伝子Cry1/2がコードする 時計タンパク質CRY1/2のことで、日周性遺伝子発現をフィードバック抑制する。別名クリプトクローム。
フィードバックループ; 体内分子時計においては、時計遺伝子Cryが転写、翻訳されてできた時計タンパク質CRYが、BMAL1の機能を阻害することにより、自らの時計遺伝子Cryの発現を抑制するというループ状の反応回路のこと。
位相;体内時計のよう周期的に振動するものが一周期(一日)内のどの位置(時刻)にいるかを示す。
逆位相;2つの周期的振動の間で、時刻のずれが半日程度みられること。
タンパク質アセチル化;タンパク質の特定のアミノ酸(BMAL1ではLys537, 537番目の リジン)にアセチル基を化学結合させる修飾反応。
脱アセチル化酵素SIRT1;タンパク質のアセチル基を外す酵素の一つ。
生物発光;ホタルのような生物にみられる発光現象。ホタルではルシフェラーゼという酵素が担う。
CK2;タンパク質リン酸化と反応を触媒する酵素の一つで、CK2αという触媒反応を担う部分(サブユニット)とCK2βという反応の調節を担う部分からなる。別名カゼインキナーゼ2。
タンパク質リン酸化;タンパク質の特定のアミノ酸(BMAL1ではSer90, 90番目のセリン)にリン酸を化学結合させる修飾反応で、様々なタンパク質の機能調節に関わる。
時計遺伝子;体内時計機能の中核を担う遺伝子で、時計タンパク質をコードする。この遺伝子を壊すと、体内時計機能が消失する。
時計タンパク質;体内時計機能の中核を担うタンパク質で、日周性遺伝子発現の調節に関わる。
時計タンパク質BMAL1; 日周性遺伝子発現を促進する。
BMAL1–CLOCK複合体;時計タンパク質BMAL1とCLOCKが1対1で結合したもので、BMAL1はこの形で、日周性遺伝子発現を促進できるようになる。
時計タンパク質CRY; 時計遺伝子Cry1/2がコードする 時計タンパク質CRY1/2のことで、日周性遺伝子発現をフィードバック抑制する。別名クリプトクローム。
フィードバックループ; 体内分子時計においては、時計遺伝子Cryが転写、翻訳されてできた時計タンパク質CRYが、BMAL1の機能を阻害することにより、自らの時計遺伝子Cryの発現を抑制するというループ状の反応回路のこと。
位相;体内時計のよう周期的に振動するものが一周期(一日)内のどの位置(時刻)にいるかを示す。
逆位相;2つの周期的振動の間で、時刻のずれが半日程度みられること。
タンパク質アセチル化;タンパク質の特定のアミノ酸(BMAL1ではLys537, 537番目の リジン)にアセチル基を化学結合させる修飾反応。
脱アセチル化酵素SIRT1;タンパク質のアセチル基を外す酵素の一つ。
生物発光;ホタルのような生物にみられる発光現象。ホタルではルシフェラーゼという酵素が担う。
添付資料:

図1 日周性時計タンパク質リン酸化は体内分子時計のギアシフトを担う
CK2による時計タンパク質BMAL1のリン酸化(タンパク質の化学修飾)が引き金(リン酸化ギア)となって、時計遺伝子のコードするCRYタンパク質の発現が促進(シフトアップ)される。CRYは日周性遺伝子発現と日周性BMAL1リン酸化の両方を抑制(シフトダウン)する。脱リン酸化されて分解を受けなかったBMAL1は次のサイクルで、新規合成されたBMAL1とともに再びリン酸化を受ける。
このサイクルが一日周期で起こる。
CK2による時計タンパク質BMAL1のリン酸化(タンパク質の化学修飾)が引き金(リン酸化ギア)となって、時計遺伝子のコードするCRYタンパク質の発現が促進(シフトアップ)される。CRYは日周性遺伝子発現と日周性BMAL1リン酸化の両方を抑制(シフトダウン)する。脱リン酸化されて分解を受けなかったBMAL1は次のサイクルで、新規合成されたBMAL1とともに再びリン酸化を受ける。
このサイクルが一日周期で起こる。
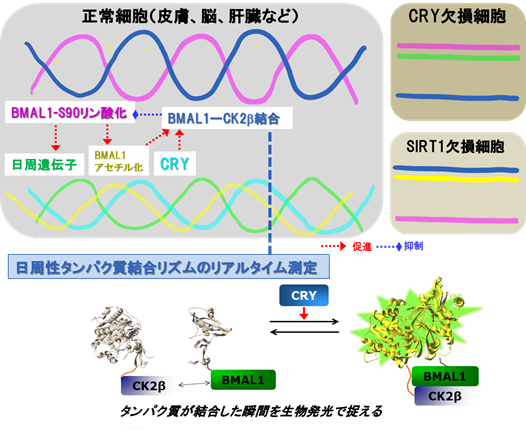
図2 日周性時計タンパク質リン酸化の振動メカニズムを捉える
正常細胞にみられるBMAL1-S90(セリン90)リン酸化の日周リズムは、CRY欠損細胞では消失し、常に高いレベルとなっている。BMAL1-S90リン酸化は日周遺伝子発現を亢進し、増加したCRYはBMAL1-CK2β結合を促進することにより、BMAL1-S90リン酸化を抑制する。正常細胞ではBMAL1-S90リン酸化と逆位相の日周性BMAL1-CK2β結合リズムがみられるが、CRY欠損細胞では消失し、常に低いレベルとなっている。本研究では、日周性BMAL1-S90リン酸化抑制の指標となるBMAL1-CK2β結合の日周リズムを、ホタルルシフェラーゼの生物発光を利用し、生きた細胞において、リアルタイムで捉えることに成功した。また、BMAL1-S90リン酸化振動にBMAL1のアセチル化が重要な役割を果たしていることも示した。脱アセチル化酵素SIRT1欠損細胞では、BMAL1アセチル化と共にBMAL1-CK2β結合も高いレベルを示し、BMAL1-S90リン酸化を抑制していた。正常細胞において、BMAL1アセチル化はCRYを介するBMAL1-S90リン酸化抑制のトリガーとなる。
正常細胞にみられるBMAL1-S90(セリン90)リン酸化の日周リズムは、CRY欠損細胞では消失し、常に高いレベルとなっている。BMAL1-S90リン酸化は日周遺伝子発現を亢進し、増加したCRYはBMAL1-CK2β結合を促進することにより、BMAL1-S90リン酸化を抑制する。正常細胞ではBMAL1-S90リン酸化と逆位相の日周性BMAL1-CK2β結合リズムがみられるが、CRY欠損細胞では消失し、常に低いレベルとなっている。本研究では、日周性BMAL1-S90リン酸化抑制の指標となるBMAL1-CK2β結合の日周リズムを、ホタルルシフェラーゼの生物発光を利用し、生きた細胞において、リアルタイムで捉えることに成功した。また、BMAL1-S90リン酸化振動にBMAL1のアセチル化が重要な役割を果たしていることも示した。脱アセチル化酵素SIRT1欠損細胞では、BMAL1アセチル化と共にBMAL1-CK2β結合も高いレベルを示し、BMAL1-S90リン酸化を抑制していた。正常細胞において、BMAL1アセチル化はCRYを介するBMAL1-S90リン酸化抑制のトリガーとなる。
【お問い合わせ先】
東邦大学 法人本部 経営企画部
〒143-8540 大田区大森西5-21-16 TEL 03-5763-6583 FAX 03-3768-0660
Email:press(アットマーク)toho-u.ac.jp URL:www.toho-u.ac.jp
東京大学 大学院理学系研究科・理学部
特任専門職員 武田加奈子、准教授・広報室副室長 横山広美
TEL:03-5841-8856 E-mail:kouhou(アットマーク)adm.s.u-tokyo.ac.jp










